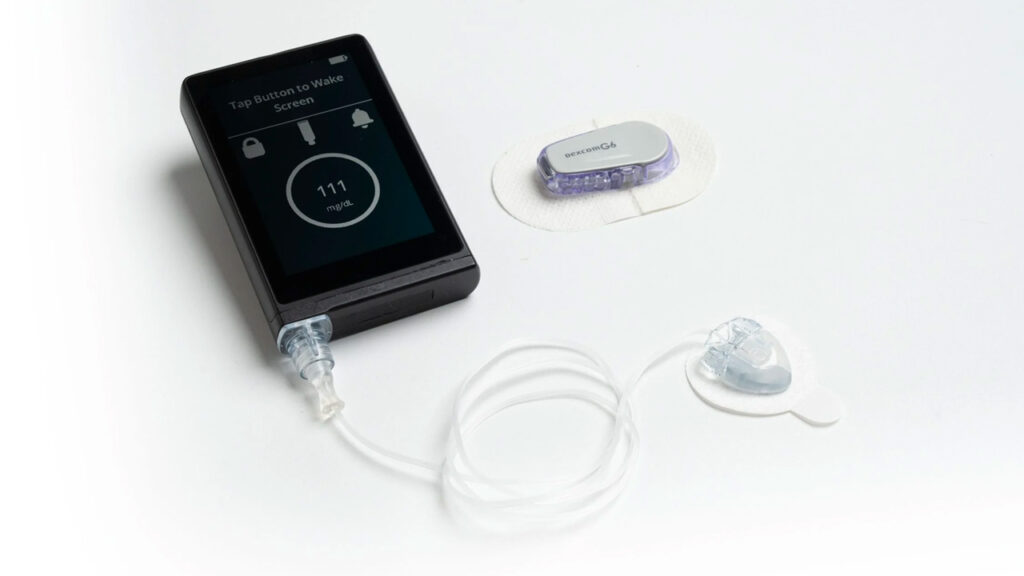
Le 23 mai 2023, la Food and Drug Administration (FDA) des États-Unis a autorisé le système de pancréas bionique iLet® à insuline seulement pour les personnes âgées de 6 ans et plus atteintes de diabète de type 1 (DT1). Ce système de pancréas artificiel est conçu pour établir et administrer des doses d’insuline de manière autonome afin de contrôler la glycémie.
Qu’est-ce qu’un « pancréas artificiel» ?
Les systèmes d’administration automatisée d’insuline ou « pancréas artificiels » sont des systèmes automatisés conçus pour imiter un pancréas pleinement fonctionnel en réglant automatiquement l’administration d’insuline en fonction des variations dans les niveaux de glucose dans le sang.
Comment fonctionne le système de pancréas bionique iLet® à insuline seulement ?
Cette nouvelle technologie d’appareil comprend un algorithme et une pompe à perfusion intégrée qui communiquent directement avec un glucomètre continu intégré compatible et autorisé par la FDA,agissant ainsi à titre de pancréas artificiel ou de système de dosage automatisé d’insuline.
Le système iLet ® est conçu de sorte que l’utilisateur n’entre que son poids pour que le système amorce le traitement. Le système de pancréas artificiel commence à fonctionner immédiatement après pour contrôler automatiquement les niveaux de glucose dans le sang, sans que l’utilisateur ait à calculer les glucides, à régler les taux d’administration d’insuline ou à administrer de l’insuline supplémentaire pour les repas ou les corrections. (L’utilisateur doit indiquer si la quantité de glucides dans un repas est faible, moyenne ou importante, et l’algorithme apprend à répondre aux besoins individuels en insuline avec le temps).
La demande d’approbation s’est appuyée sur un essai clinique pivot multicentrique randomisé sur le pancréas bionique iLet® à insuline seulement , lequel a testé la configuration à insuline seulement auprès de 440 adultes et enfants âgés de 6 ans et plus atteints de DT1. L’essai clinique a satisfait à tous les indicateurs de résultats clés, démontrant une amélioration des résultats par rapport à la norme de soins pour les personnes atteintes de DT1 :
- Le taux HbA1c moyen est passé de 7,9 % à 7,3 % après 13 semaines.
- Amélioration dans le temps passé dans la cible (70-180 mg/dL) avec 2,6 heures de plus par jour en moyenne, passant de 51 % à 65 % après 13 semaines.
- Aucune augmentation du risque d’hypoglycémie
Quelles sont les technologies de pancréas artificiel actuellement offertes au Canada ?
Les systèmes de pancréas artificiels suivants sont offerts au Canada : Tandem Control-IQ™ (2019, ) Medtronic 770G (2020), Medtronic 780G (2023).
En janvier 2023, la FDA a également autorisé l’application de dosage d’insuline automatisé Tidepool Loop pour la gestion du DT1. Cette boucle est essentiellement un algorithme qui peut, ultimement, être utilisé avec les pompes à insuline et les glucomètres continus offerts sur le marché. Le développement de cet algorithme a été soutenu par des subventions de FRDJ International en partenariat avec le Helmsley Charitable Trust. Tidepool n’a pas encore annoncé ses partenaires de lancement initial de l’appareil et son utilisation n’a pas encore été approuvée au Canada. Nous continuerons de suivre les développements à cet effet et fournirons des mises à jour dès qu’elles seront communiquées.
Impact de FRDJ
FRDJ a lancé le projet de pancréas artificiel aux États-Unis il y a plus de 15 ans dans le cadre de son engagement à améliorer la vie des personnes atteintes de DT1, tandis que les recherches progressent pour trouver des thérapies de guérison. À ce jour, FRDJ a financé plus de 140 millions de dollars de recherche sur le pancréas artificiel.
FRDJ International a soutenu le développement de l’algorithme et la recherche préclinique et clinique précoce en partenariat avec le Helmsley Charitable Trust, par l’entremise de subventions à :
- Firas El-Khatib, Ph. D. qui a reçu une bourse de recherche postdoctorale de FRDJ de 2006 à 2007 et est maintenant cofondateur et vice-président de la recherche et de l’innovation chez Beta Bionics.
- Ed Damiano, Ph. D., cofondateur et président exécutif de Beta Bionics, de 2009 à 2011.
- Steven J. Russell, M.D., Ph. D., qui a reçu une subvention de 2013 à 2016 et est chercheur principal pour tous les essais cliniques sur le système iLet ®.
Quelle est la suite?
Bien que ce nouveau système de pancréas artificiel ne soit pas encore approuvé ou offert au Canada, le fait qu’il ait été autorisé aux États-Unis permet d’espérer qu’il pourra être approuvé pour les Canadiennes et les Canadiens atteints de DT1 dans un avenir proche.
FRDJ continuera de suivre l’évolution de la situation et fournira des mises à jour au fur et à mesure qu’elles seront communiquées. Il est à espérer que cela deviendra un nouvel outil pour aider à gérer et à améliorer la gestion quotidienne du DT1, pendant que les travaux de recherche se poursuivent pour trouver des thérapies de guérison.




